甘云医药科技(上海)有限公司
10 年
手机商铺
- NaN
- 0
- 0
- 1
- 0
推荐产品
公司新闻/正文
GMP:药用辅料安全的红线
1183 人阅读发布时间:2017-09-11 10:19
一、何为GMP?
GMP(生产质量管理规范)是一套适用于制药、食品等行业强制性标准,要求企业从原料、人员、设施设备、生产过程、包装运输、质量控制等方面按国家有关法规达到卫生质量要求,形成一套可操作的作业规范帮助改善企业卫生环境,及时发现生产过程中存在的问题。简要的说,GMP要求制药、食品等生产企业应具备良好的生产设备,合理的生产过程,完善的质量管理和严格的检测系统,确保最终产品质量(包括食品安全卫生)符合法规要求。
二、医药产品的GMP认证
中国卫生部于1995年7月11日下达卫药发(1995)第35号"关于开展药品GMP认证工作的通知"。药品GMP认证是国家依法对药品生产企业(车间)和药品品种实施GMP监督检查并取得认可的一种制度。国家食品药品监督管理总局负责全国药品 GMP 认证工作。国家食品药品监督管理总局药品认证管理中心承办药品 GMP 认证的具体工作。
三、中国药用辅料GMP认证现状
近年来,药用辅料的质量管理模式正在不断磨合改造。随着药品安全监管“严”时代的到来,加强药用辅料的质量控制已不仅仅是药用辅料生产企业的事,也是制剂生产企业的重要责任。然而,由于我国药用辅料起步和发展较晚,质量水平参差不齐。尽管2001年出台的《药品管理法》以及2006年出台的《药用辅料生产质量管理规范》对药用辅料的管理提出了相关要求,但仅为指导性原则。药用辅料GMP实施指南正在产业的期待中酝酿发酵。
2006年3月出台的《药用辅料生产质量管理规范》分别在机构、人员和职责、厂房和设施、设备、物料、卫生、验证、文件、生产管理、质量保证和质量控制、销售、自检和改进等方面作了规定,供企业在生产过程中参照执行。全国医药技术市场协会药用辅料技术推广专业委员会主任宋民宪指出,该文件要求各地结合本地实际情况参照执行,只是规定了相关原则。据了解,不少药用辅料生产企业对上述文件中的“参照执行”并没有足够的认识和重视,甚至有部分药用辅料企业认为这意味着“不要求执行”。事实上,2013年2月起执行的《加强药用辅料监督管理的有关规定》已经要求地方各级药品监督管理部门加强药用辅料生产监管。对本行政区域内药用辅料生产企业开展日常监督,或根据在药品制剂生产企业监督检查中发现的问题,对药用辅料生产企业进行延伸检查。但由于目前还没有相关实施指南,很多企业暂时只按照原料药的GMP进行管理。因此,我们也呼吁相关指南能尽快推出。
有业内人士认为,质量管理的提升仍需要一段时间的努力。药用辅料GMP实施指南具有指导作用,可以由政府部门或领导组织编写、行业组织组织编写或者由药用辅料企业自己编写。制药企业与药辅企业通过约定标准提升产品质量控制,可望成为未来行业重要的发展趋势之一。
四、药用辅料GMP在欧洲的法规情况
在欧洲,药品生产商生产中所使用的活性物质原料必须是在符合GMP的条件下生产的。药品的GMP也适用于某些药用辅料。药用辅料物质的列表和GMP细则的制定依据欧盟委员会的指南。
欧洲药用辅料GMP当前所讨论的主要问题有:来源于人类/动物的辅料有潜在的病菌风险,来源于动物的辅料有潜在的TSE风险,要求消毒的辅料和使用前无相关灭菌方案的辅料,要求控制热源/内毒素的辅料以及丙二醇、甘油等。欧洲GMP指南细则对这些辅料进行了详细要求。此外,IPEC欧洲也在积极地参与此讨论。
指南2001/83附件I和新的相关文件2003/63中指出:欧洲药典(Ph.Eur.)的规定适用于所有药品物质的生产和相关药学出版物内容。欧洲药典通则中所说的“药用物质”是指按设计规定生产的确保质量的物质,须符合各自规定或获得批准的标准。
根据欧洲GMP指南的第五章节,原材料的采购是生产的一个重要环节,参与的员工必须对供应商有特别的和完全的了解。原材料必须从获得批准的具有相关资质的供应商采购。如有可能,直接从生产者采购。欧洲辅料的采购和供应商风险评估基于必要的GMP要求。
IPEC——国际药用辅料协会致力于在全球范围内推进制药及相关医疗保健产品的质量、安全和功能标准。IPEC欧洲、IPEC美国和英国PQG出版了《药用辅料GMP IPEC》指南。该指南由1995年首次出版并于2006年发行第三版。IPEC会员公司在生产中应依据IPEC GMP指南作为质量控制标准。
IPEC/PQG GMP指南依据在欧洲广泛应用的ISO9001:2000的格式,从定义、一般性指南(适用于药用辅料GMPs)、辅料的质量系统(文件和记录)、管理职责(承诺和质量体系)、管理资源(员工、工厂、设备)、生产过程(辅料的生产)、检验分析和改进(质量保证)以及质量审计等方面进行了详细的规定。
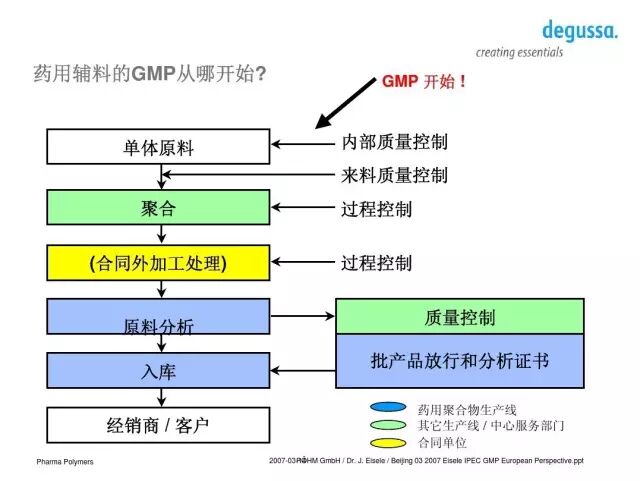
五、欧洲药用辅料GMP程序详解
首先,药用辅料生产者应当进行必要的员工培训,然后再根据相关程序进行生产、取样和测试(在线控制SOPs)。一个符合要求的质量体系应包括独立的QA(Qulity Assurance)进行批记录审查和批产品放行(原始记录保留10年,样品留样到保质期后的一年)和独立的QC(Qulity Control)实验室进行最终产品的控制。还应当包括抽样批号的最小稳定性考察并保留所有产品的稳定性数据。
一个符合要求的GMP管理由多个系统协调进行。QA审批所有关键性文件(包括质量标准、生产SOP/检测方法等),实验室和车间应当负责维护和计量。此外,还应包括控制条件下的仓储系统、客户投诉处理和跟踪系统、不合格产品的处理和控制以及重大变更坚持客户信息变更控制程序等。
资源管理

生产过程管理

计量、分析和改进管理

六、中国药用辅料GMP认证的难题
药用辅料GMP规范的推广还是不可避免地遭遇到了经济成本的难题。
首先,若执行GMP规范,生产企业将为此付出高成本是毋庸置疑的。而问题的关键在于成本的回报。一旦企业付出了过多的成本,市场的需求量又无法使生产企业收回成本,行业或将面临一场变动。而这还将对制药企业在药物传递系统开发方面造成相对不利的影响。
其次,辅料生产商不光生产符合药用标准的药用辅料,同时也生产供应精细化工市场的辅料产品。为生产药用辅料,辅料生产商必须对这些产品采用不同的生产标准,如药用的溶剂、防腐剂与缓冲剂同样也是主要的化工原料,在染料、调味品方面也有着广泛的应用,但实际生产中却要根据不同的用途而采取不同的生产标准。
根据统计数据,药用辅料占其产品结构比重仅为10%左右,有时甚至不到5%,这也正是为什么在大多数情况下,药用辅料往往由大规模低利润率的大型生产基地生产的原因。所以说,如果执行GMP规范,这些GMP规范中的差异在经济成本上占有相当重要部分,这也是生产商不得不考虑的问题。
药用辅料生产实行GMP规范的另一个难度挑战,则来自于药用辅料成分和作用的多变性。药用辅料传统的作用往往在于帮助主药成分的释放、促进主药成分的溶解或是用于一些专门的用途,如在生产药片时为了防止粘冲等等。不过,现如今药用辅料可能要扮演更大的角色了——虽然它们没有什么药理作用,却可以促进主药成分的“活力”。而随着生物技术的进步和以蛋白学为基础的新疗法的兴起,药用辅料的定义也在发生改变,新的抗体或其他新概念产品都被纳入了药用辅料的范畴。显然,这些让人眼花缭乱的变化为执行GMP规范增加了不少难度。




